Olek Karolina
Zakład Dydaktyczny Chemii Fizycznej i Radiochemii
Pracownia Elektrochemicznych Źródeł Energii
Wyznaczanie kinetycznych i rozpuszczalnikowych efektów izotopowych w reakcji enzymatycznego rozkładu fluoropochodnych L-tryptofanu
Karolina Olek
Promotor: dr hab. Zbigniew Rogulski
Opiekun : dr Elżbieta Winnicka
Tryptofanaza (Tpase, EC 4.1.99.1) jest enzymem odpowiedzialnym za katalizowanie reakcji rozkładu L-tryptofanu oraz jego fluoropochodnych do indolu (fluoroindolu), kwasu pirogronowego oraz amoniaku1. Kwas pirogronowy pod wpływem enzymu dehydrogenazy L-mleczanowej (LDH, EC 1.1.1.27) ulega redukcji do kwasu L-mlekowego. W odpowiednich warunkach reakcja ta jest odwracalna. Do zbadania mechanizmu tych reakcji zastosowano metodę kinetycznych (KIE) i rozpuszczalnikowych (SIE) efektów izotopowych2. Przebieg zachodzącej reakcji monitorowano spektrofotometrycznie, wykonując pomiar absorbancji przejścia formy zredukowanej NADH (λmax=340 nm), do formy utlenionej NAD+ (λmax=260 nm).
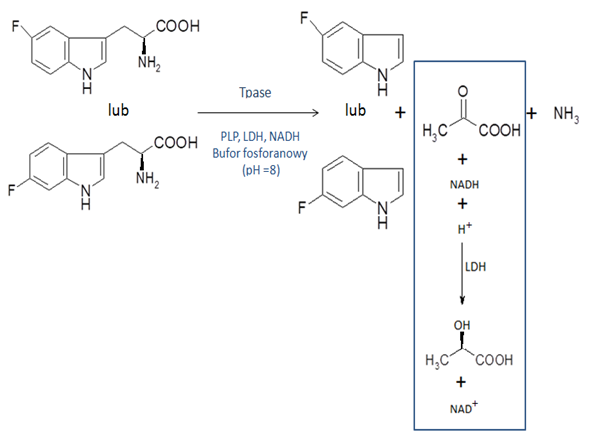
Schemat reakcji, przedstawiający wszystkie zachodzące przemiany podczas prowadzenia pomiaru spektrofotometrycznego
Celem mojej pracy magisterskiej było wyznaczenie parametrów kinetycznych (Vmax i KM) reakcji rozkładu 5’-fluoro-L-tryptofanu, 5’-fluoro-[2-2H]-L-tryptofanu, 6’-fluoro-L-tryptofanu oraz 6’-fluoro-[2-2H]-L-tryptofanu katalizowanej przez enzym tryptofanazę, w wodzie zwykłej (H2O) oraz wodzie deuterowanej (2H2O) oraz wyznaczenie kinetycznych (KIE) i rozpuszczalnikowych (SIE) efektów izotopowych.
Literatura:
[1] Y. Morino, E. E. Snell, Methods in Enzymology, 17a (1970), 439-446.
[2] F. Cook, Enzyme mechanism from isotope effects (1991) CRS Press, Boca Raton Fl, USA, pp. 151-265.

