Hejko Monika
Zakład Chemii Fizycznej i Radiochemii
Pracownia Elektrochemicznych Źródeł Energii
Enzymatyczna synteza halogenopochodnych L-tryptofanu znakowanych deuterem w pozycji 2 łańcucha bocznego
Monika Hejko
Promotor: dr Elżbieta Winnicka
L-tryptofan (L-Trp) jest substratem stosowanym do produkcji antybiotyków np.; daptomycyny – leku zwalczającego infekcje spowodowane przez bakterie gram dodatnie a także prekursorem wielu substancji bioaktywnych np. alkaloidów: sporyszu (prekursor w syntezie leku powstrzymującego krwawienie z dróg rodnych) oraz winblastyny (lek przeciwnowotworowy). Pochodne L-Trp są półproduktami szeroko stosowanymi przemyśle farmaceutycznym, chemicznym i agrochemicznym. Halogenopchodne L-Trp znajdują zastosowanie w syntezie wielu biologicznie aktywnych naturalnych produktów np. rebeccamycin (składnik leków przeciwnowotworowych) i pirolnitryna (antybiotyk przeciwgrzybiczny). Ponadto wykorzystywane są w biosyntezie kombinatoryjnej do naturalnego wytwarzania analogów pacydamycyny (antybiotyk peptydowy, przeciwdrobnoustrojowy) i alkaloidów roślinych.1-2
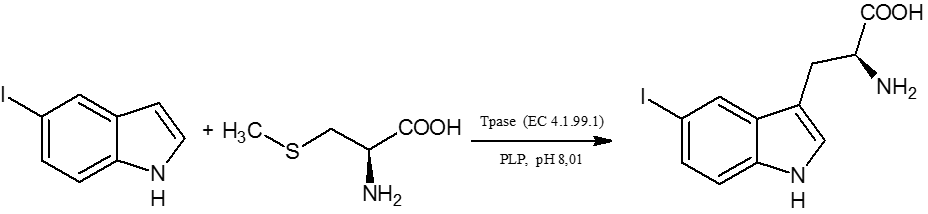
Celem mojej pracy magisterskiej było opracowanie syntezy enzymatycznej halogenopochodnyh L-Trp znakowanych deuterem w łańcuchu bocznym. Wykorzystałam w tym celu reakcję sprzęgania S-metylo-L-cysteiny z jodoindolem lub chloroindolem, która była katalizowana przez enzym tryptofanazę (Tpase EC 4.1.99.1).
Literatura:
[1] R. M. Smith, T. Willemse, D. S. Gkotsi, W. Schepens, B. U. W. Maes, S. Ballet, R. J. M. Goss, Org Lett. 2014, 16 (10), 2622-2525.
[2] Chen, S. Genapathy, P. M. Fischer, W. C. Chan, Org. Biomol. Chem., 2014, 12, 9764-9768.

