Maliszewski Benon
Zakład Dydaktyczny Chemii Organicznej
Pracownia Stereokontrolowanej Syntezy Organicznej
Enancjoselektywne alkenylowanie aldehydów z użyciem zabezpieczonych alkoholi propargilowych
Benon Maliszewski
Promotor: prof. dr hab. Tomasz Bauer
Addycja związków cynkoorganicznych do grupy karbonylowej aldehydów i ketonów stanowi bardzo atrakcyjną metodę tworzenia wiązań węgiel-węgiel. W przeciwieństwie do związków magnezoorganicznych, addycja większości związków cynkoorganicznych, z uwagi na ich mniejszą reaktywność, wymaga obecności katalizatora – stwarza to wiele możliwości pod względem kontroli stereochemicznej. Wprowadzenie do środowiska reakcji chiralnych aminoalkoholi lub amionotioli pozwala na otrzymanie drugo- i trzeciorzędowych alkoholi
z wysokimi wydajnościami oraz nadmiarami enancjomerycznymi sięgającymi w wielu przypadkach powyżej 99 %.
Obiektem przeprowadzonych badań była reakcja alkenylowania aldehydów z użyciem związków cynkoorganicznych wygenerowanych in situ z pochodnych alkoholu propargilowego w wyniku hydrocyrkonowania, a następnie transmetalacji cyrkon-cynk według procedury zaproponowanej przez Petera Wipfa i Setha Ribe [1] (Schemat 1). Celem było otrzymanie odpowiednich alkoholi allilowych, bardzo użytecznych w syntezie organicznej bloków budulcowych, z możliwie wysokimi nadmiarami enancjomerycznymi i dobrymi wydajnościami.
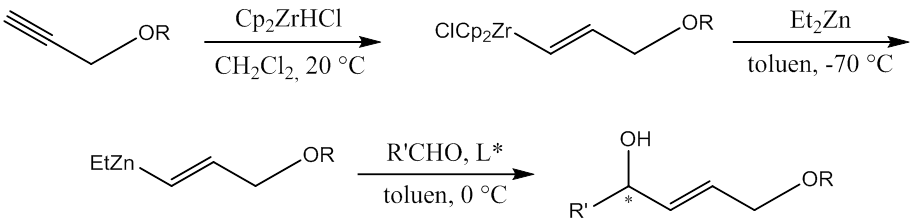
Schemat 1. Alkenylowanie aldehydów z zastosowaniem transmetalacji cyrkon-cynk
Początkowe prace nad optymalizacją tej procedury pozwoliły na uzyskanie umiarkowanie dobrych nadmiarów enancjomerycznych sięgających 80 %. Wiedząc, że obecne w mieszaninie reakcyjnej pochodne cyrkonocenu katalizują achiralną ścieżkę reakcji zdecydowano się na nieopisane dotąd w literaturze użycie eteru koronowego w celu utworzenia nieaktywnych katalitycznie kompleksów cyrkonu. Podejście to okazało się słuszne i dla modelowych substratów pozwoliło na zwiększenie nadmiaru enancjomerycznego aż do 96 %. Opracowana metoda umożliwiła syntezę szeregu nowych, potencjalnie użytecznych związków o bardzo wysokiej czystości enancjomerycznej.
Literatura:
[1] Wipf P., Ribe S., J. Org. Chem. 1998, 63, 6454-6455.

