Kaczmarek Monika
Zakład Chemii Teoretycznej i Strukturalnej
Pracownia Teorii Biopolimerów
Badanie oddziaływania enzymu CYP109B1 z wybranymi ligandami przy użyciu oprogramowania Rosetta
Monika A. Kaczmarek
Promotor: dr hab. Dominik Gront
Opiekun: mgr Joanna Macnar
Enzymy P450 należą do rodziny białek uczestniczących w transporcie elektronów w procesie zwanym fosforylacją oksydacyjną. Posiadają one aktywność monooksygenazy, dzięki czemu jeden atom cząsteczki tlenu wprowadzany jest do substratu, a drugi do cząsteczki wody. Do zajścia takiej reakcji jednak wymagana jest obecność drugiego białka, które stanowi donor elektronu. Jego przykładem jest ferredoksyna. Enzymy te katalizują reakcje biosyntezy związków endogennych, głównie lipidów. Metabolizują i utleniają związki toksyczne oraz ksenobiotyki stanowiące około 75% leków [1]. Centrum katalityczne stanowi hem.
Głównym obiektem naszych badań jest CYP109B1 należący do grupy cytochromów P450 wykorzystywany w wielu pracach biotechnologicznych ze względu na niepoznany jeszcze mechanizm transferu elektronu czy brak dokładnej analizy wiązania substratu [2]. W naszych badaniach wykorzystaliśmy metody symulacji komputerowej w celu przewidzenia miejsca oddziaływania znanych ligandów z CYP109B1. Dzięki wyznaczonym eksperymentalnie w badaniach in vitro stałym dysocjacji możemy zweryfikować zastosowane przewidywane metody teoretyczne. Kolejnym krokiem jest udoskonalenie stosowanej metody obliczeniowej, aby jeszcze lepiej odtwarzać dane eksperymentalne.
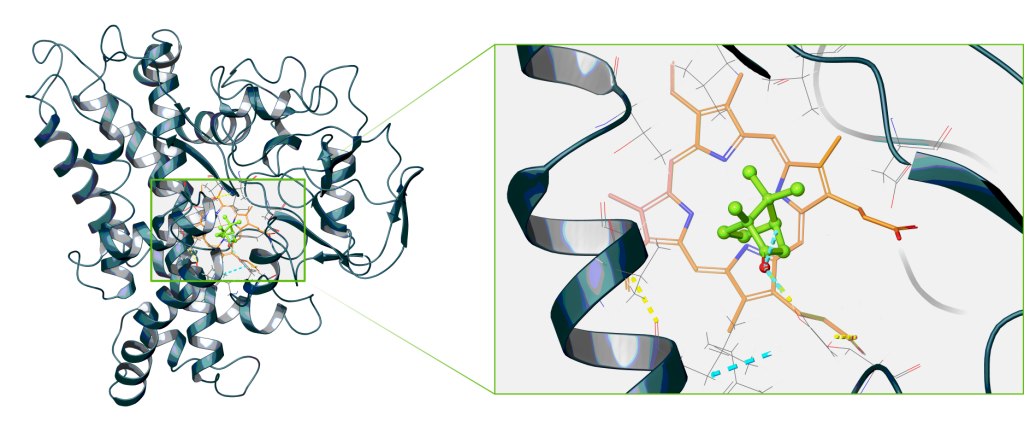
Rysunek.1. Cytochrom P450cam (PDBid: 2m56) oraz zbliżenie na jego miejsce aktywne z hemem i związaną kamforą w kolorach pomarańczowym i zielonym, odpowiednio.
Literatura:
[1] Baj-Rossi, C., Micheli, G. D., and Carrara, S. In Tech 2011, Chapter 21, pp 447−482.
[2] Appl Microbiol Biotechnol (2010) 87:595-607.

