Kamińska Magdalena
Zakład Chemii Organicznej
Pracownia Syntezy Organicznych Nanomateriałów i Biomolekuł
Badanie mechanizmów reakcji katalizowanych przez dehydrogenazę L-mleczanową.
Magdalena Kamińska
Promotor: dr Katarzyna Pałka
Enzym dehydrogenaza L-mleczanowa (EC. 1.1.1.27, LDH) katalizuje odwracalne reakcje redoks hydroksykwasów i ketokwasów alifatycznych oraz aromatycznych w obecności kofaktora NADH (reakcja redukcji) lub NAD+ (reakcja utlenienia).
Pierwszym etapem badań była optymalizacja warunków enzymatycznej reakcji redukcji kwasu fenylopirogronowego (PPA) do kwasu fenylo-L-mlekowego (PLA), Schemat 1.
Podjęto próbę syntezy izotopomerów kwasu fenylo-L-mlekowego znakowanego izotopami wodoru
w pozycji drugiej łańcucha bocznego, tj.: [2-2H]-PLA, [2-3H]-PLA oraz [2-2H/3H]-PLA.
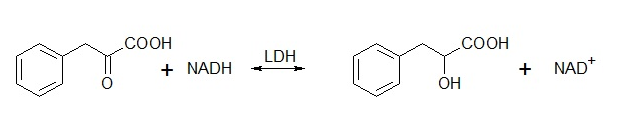
Schemat 1. Enzymatyczna reakcja redukcji kwasu fenylopirogronowego.
Kolejnym etapem było przebadanie kinetyki reakcji redukcji kwasu pirogronowego (PA) oraz jego halogenopochodnych (3-Br-PA, 3-F-PA), a także reakcji redukcji kwasu fenylopirogronowego (PPA) oraz p-OH-fenylopirogronowego (p-OH-PPA). Wyznaczono parametry kinetyczne (Vmax– szybkość maksymalna i Km– stała Michaelisa) w powyższych reakcjach przebiegających w środowisku buforu przygotowanego na bazie wody lekkiej (H2O) oraz wody ciężkiej (D2O). Porównując otrzymane wartości kinetyczne wyznaczono także izotopowe efekty rozpuszczalnikowe (SIE). Badania zostały przeprowadzone w celu głębszego poznania mechanizmu działania enzymu dehydrogenazy L-mleczanowej (LDH). Otrzymane wyniki mają charakter nie tylko poglądowy, ale także praktyczny, gdyż mogą być wykorzystane w medycynie nuklearnej podczas syntez związków biologicznie czynnych.

