Gałązka Kinga
Zakład Chemii Organicznej
Pracownia Chemii Związków Naturalnych
Synteza i próba zastosowania w przemianach asymetrycznych nowego ligandu zawierającego motyw pirydyny
Kinga Gałązka
Promotor: prof. dr hab. Zbigniew Czarnocki
Opiekun: mgr. Piotr Pomarański
Atropoizomeria jest rodzajem stereoizomerii wywołanym zahamowaniem swobody rotacji wokół wiązania pojedynczego spowodowanym zwykle przestrzenną budową cząsteczek. Bariera obrotu jest czasem wystarczająco wysoka, by umożliwić izolowanie określonych rotamerów jako pojedynczych i stabilnych związków w temperaturze pokojowej[1-2]. Oligoarylopirydyny są grupą związków w których występuje zjawisko atropoizomerii.
Nasza grupa od wielu lat prowadzi intensywne badania związane z syntezą atropoizomerycznych pochodnych oligoarylopirydyn wykorzystując reakcję sprzęgania Suzuki-Miyaury, jako podstawową metodę tworzenia wiązań C-C.
Celem mojej pracy była optymalizacja warunków syntezy chiralnych pochodnych z grupy 4-alkoksy-2,6-lutydyny. Badania zakończyłam otrzymaniem produktów monoarylowania z dobrymi nadmiarami enancjomerycznymi oraz wysokimi wydajnościami (Rys. 1.). Przeprowadzając krystalizację jednego z otrzymanych atropoizomerycznych pochodnych (3-bromo-4-metoksy-2,6-dimetylo-5-(naftalen-1-yl)pirydyny) udało mi się otrzymać związek czysty optycznie, którego konfiguracja absolutna ustalona została przy pomocy rengenoanalizy strukturalnej.[4]
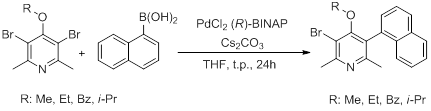
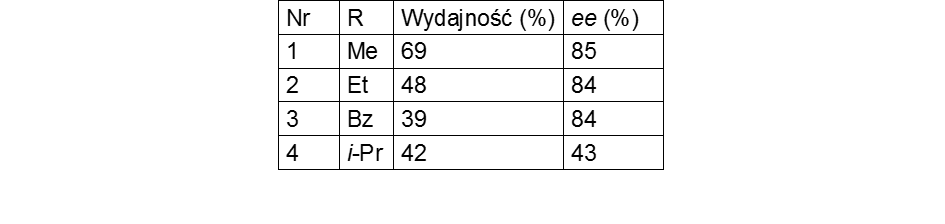
Rys. 1. Schemat syntezy atropoizomerycznych pochodnych naftylopirydyny.
Ze względu na wzrost zainteresowanie nowymi ligandami, a zarazem katalizatorami wykorzystywanymi w reakcjach katalizowanych palladem, moim kolejnym celem była synteza katalizatora palladowego z nowym chiralnym ligandem typu N,N (Rys. 2.). W kilku etapowej syntezie udało mi się otrzymać oczekiwany katalizator, który zostanie przetestowany pod względem efektywności oraz stereoselektywności w odpowiednich reakcjach.
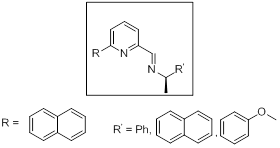
Rys. 2. Schemat nowego chiralnego ligandu typu N,N.
Literatura:
[1] R. Kuhn, Molecular Asymmetric in Stereochemistry (Ed.:Frendenberg), F. Deutike, Leipzig – Wien, 1993, 803-824.
[2] G. Bringmann, A. J. P. Mortimer; P. A. Keller, M. J. Gresser, J. Garner, M. Breuning Angew. Chem. Int. Ed., 2005, 44, 5384-5427.
[3] P. Pomarański, S. Samanta, P. Roszkowski, J.K. Maurin, Z. Czarnocki, Tetrahedron Lett. 2016, 57, 42, 4713-4717.

