Janowska Maria
Zakład Dydaktyczny Chemii Organicznej
Pracownia Syntezy Organicznych Nanomateriałów i Biomolekuł
Synteza N2-funkcjonalizowanych pochodnych guanozyny
Maria Janowska
Promotor: dr hab. Marzena Jankowska-Anyszka
Opiekun: dr Karolina Piecyk
We wszystkich komórkach eukariotycznych występuje informacyjny kwas rybonukleinowy – mRNA, który na swoim końcu 5’ zawiera strukturę zwaną kapem. Nieodłączną częścią kapu są: 7-metyloguanozyna, ryboza oraz łańcuch 5’,5’-trifosforanowy, który łączy zasadę nukleinową z pierwszym transkrybowanym nukleozydem. Ze względu na znaczące funkcje pełnione na różnych etapach ekspresji genów, struktura kapu i jego analogi są od wielu lat obiektem intensywnych badań. Modyfikacje tej struktury mogą w dość istotny sposób wpływać zarówno na jej funkcje biologiczne (odporność na hydrolizę pod wpływem enzymów degradujących kap, powinowactwo do białek wiążących kap, łatwiejszy transport przez błony komórkowe) jak również analogi kapu mogą stanowić cenne narzędzie w badaniach mechanizmów zachodzących wewnątrz komórki. Celem mojej pracy magisterskiej była/jest synteza pochodnych N2 guanozyny prowadząca do otrzymania dwóch nowych klas związków (pochodnych mononukleotydowych kapu – Rysunek 1):
- będących inhibitorami procesu inicjacji translacji posiadających pierścieniowe modyfikacje powstałe przez sprzęganie oksymów z pochodną mononukleotydową N2-propargiloguanozyny
- stanowiących narzędzia do dalszego rozbudowywania analogów kapu otrzymanych poprzez wprowadzanie odpowiednich linkerów takich jak etylenodiamina, PEG-NH2 PEG-N3
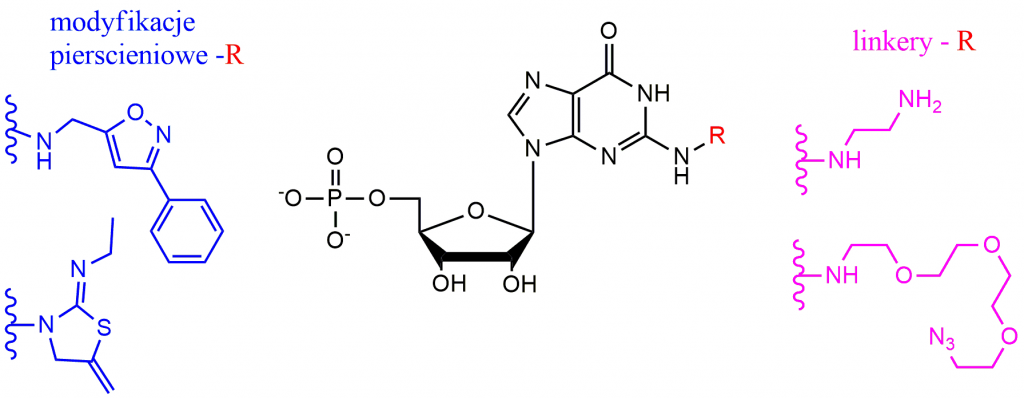
Rysunek 1:Wprowadzone modyfikacje
Otrzymane w ramach pracy magisterskiej związki o potencjalnych właściwościach inhibitorowych zostaną w kolejnym etapie poddane badaniom in vitro w ekstrakcie z retikulocytów króliczych, natomiast pochodne kapu posiadające linkery będą stanowiły cenne substraty do przygotowania kolejnych analogów.
Literatura:
[1] Piecyk K., Davis R. E., Jankowska-Anyszka M., Bioorg. Med. Chem., 2012, 4781-4789.
[2] Janowska-Anyszka M., Piecyk K., Samonina-Kosicka J., Org. Biomol. Chem., 2011, 9(15), 5564-5572.
[3] Algay V., Singh I., Heaney F., Org. Biomol. Chem., 2010, 8, 391-397.
[4] Viart H., Larsen T. S., Tassone C., Chem. Commun., 2014, 50, 7800-7802.

