Rotuska Karolina
[1] Zakład Chemii Fizycznej i Radiochemii
Pracownia Spektroskopii i Odziaływań Międzycząsteczkowych
[2] Institut des Biomolécules Max Mousseron, Francja
Badanie właściwości nanomechanicznych wybranych peptydów na poziomie pojedynczej cząsteczki
Karolina Rotuska
Promotorzy: dr hab. Robert Szoszkiewicz, prof. UW2; dr. Anna Puszko1
Praca magisterska ma na celu badania właściwości nanomechanicznych (stałej sztywności i współczynnika tłumienia energii mechanicznej) pojedynczych oligopeptydów oraz próbę powiązania zmian badanych właściwości nanomechanicznych ze zmianami struktury w procesach fałdowania się oligopeptydów. Zsyntetyzowano peptyd KR1 metodą SPPS. Wzór peptydu pokazano poniżej.
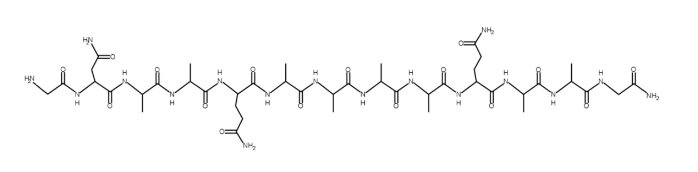
Rysunek 1: Struktura peptydu KR1
Wybrano prosty krótki α-helikalny peptyd ze względu na mała ilość oddziaływań wewnątrz helisy. Stworzono układ eksperymentalny, który pozwoli na badanie właściwości nanomechanicznych peptydu za pomocą mikroskopii AFM oraz badania struktury tegoż peptydu przy pomocy ATR-FTIR. W układzie posłużono się związkami zawierającymi struktury PEG (polieltyleno glikoli). Cześć PEG’ów zakończona jest grupami alkilowymi (co zapobiega niespecyficznym oddziaływaniom peptydu z powierzchnią), a druga część bursztyimidami, które będą łączyły się z peptydem KR1 przez wiązanie amidowe, jak pokazano na schemacie poniżej.
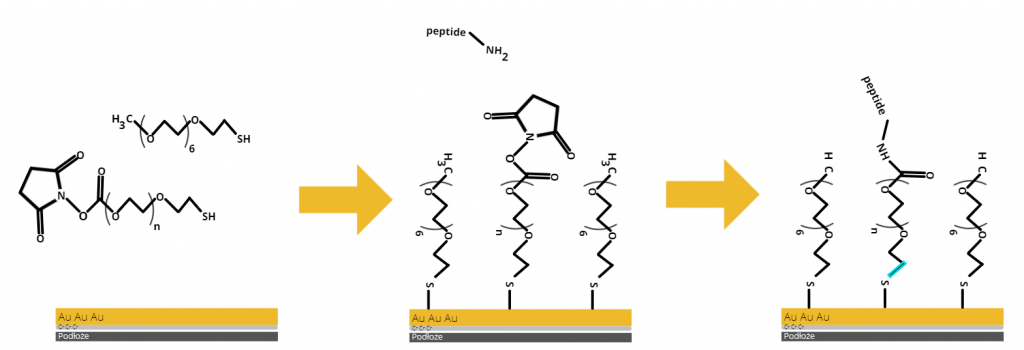
Rysunek 2: Przyłączanie do stiolowanego złota, PEG’u z bursztyimidem na końcu oraz PEG’u z grupą blokującą CH3 zmieszanych w stosunku 1:100 cząsteczek. Następnie przyłączenie peptydu przez grupę amidową do SH-PEG-NHS.
Po otrzymaniu powyższego układu zbadano próbki za pomocą mikroskopii AFM, oraz ATR-FTIR. Poniżej zaprezentowano widmo ATR-FTIR, dla peptydu KR1, osadzonego zgodzie z podejściem eksperymentalnym wraz z podpisanymi pasmami, które potwierdzają obecność pożądanych grup.
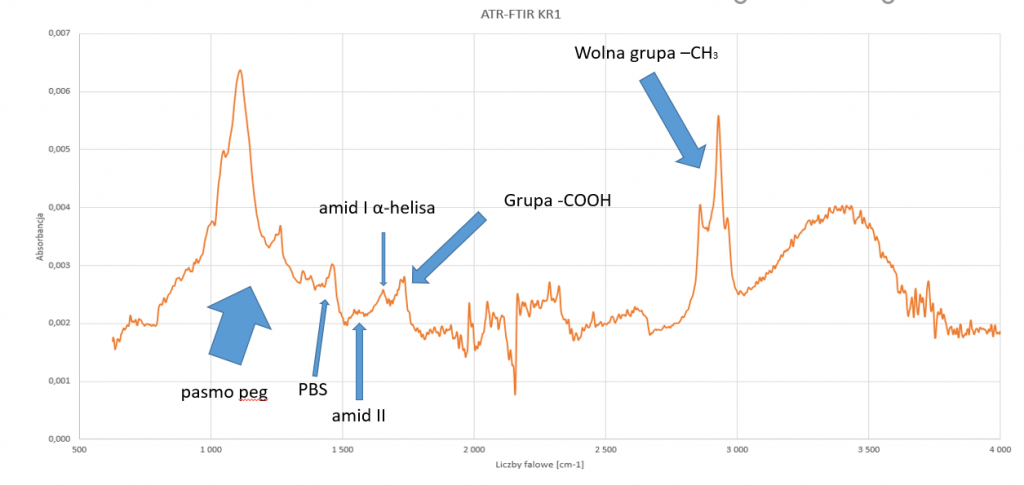
Rysunek 3: Widmo ATR-FTIR przygotowanych próbek, wraz z zaznaczonymi charakterystycznymi pasmami.
Poniżej zaprezentowano topografie otrzymanych peptydów, osadzonych na złocie (zdjęcie 1µm x 1µm) wraz z krzywymi Force-Distance. Pomiary wykonano w trybie AC Water Topography.
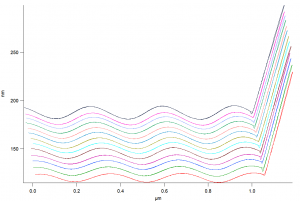
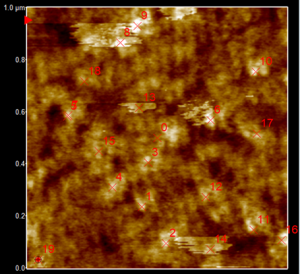
Rysunek 4: Krzywe Force-Distance wraz z obrazem topografii powierzchni próbek, na którym zaznaczono kolejno punktu wykresów. Krzywe kolejno od dołu 1-6, 8-12 oraz punkty 15 i 19. Odległość między najciemniejszym punktem (najniższym -1.530 nm) a najjaśniejszym (najwyższym 2.002 nm) na zdjęciu topografii wynosi 3,532nm.
Z nachylenia krzywych Force-Distance, będzie można odczytać sztywność, natomiast w późniejszym czasie będą kontynuowane dalsze pomiary stałej sztywności i współczynnika tłumienia.
Literatura:
[1] M. Amblard et al. Mol. Biotech. 2006 (33) 239-254.
[2] Houseman et al. Langmuir, 2003 (19) 152-1531.
[3] Natasa Stipanelov Vrande et al. 2010 (498) 71–80.

