Rejtner Martyna
Zakład Chemii Fizycznej i Radiochemii
Pracownia Elektrochemicznych Źródeł Energii
Grupa: Radiochemia dla Medycyny i Przemysłu
Badanie wpływu podstawienia halogenowego na przebieg reakcji katalizowanych przez dehydrogenazę L-fenyloalaninową (PheDH)
Martyna Rejtner
Promotor: dr Katarzyna Pałka
Enzymy to grupa (głównie) białek, umożliwiających przebieg reakcji, bez których życie nie byłoby możliwe. Pełnią rolę katalizatorów, poprzez obniżenie energii aktywacji [1]reakcji. Nie wpływają na położenie jej stanu równowagi, ale przyspieszają jego osiągnięcie. Obecność enzymów jest potrzebna do uzyskania odpowiedniej wydajności reakcji. Enzymy są specyficzne względem substratu, tzn. dany enzym katalizuje możliwe reakcje dla danego substratu. Wiele enzymów jest syntetyzowanych w formie proenzymów, tj. w postaci nieaktywnej formy, mających zablokowane centra aktywne. Formy nieaktywne enzymów są aktywowane w miarę zapotrzebowania. Na aktywność enzymów mają wpływ takie parametry, jak np. siła jonowa, temperatura, pH, niektóre jony.
L-fenyloalanina (L-Phe) to aminokwas, który ulega reakcji oksydacyjnej deaminacji w obecności enzymu, dehydrogenazy L-fenyloalaniny (PheDH). Produktem tej przemiany jest kwas fenylopirogronowy (PPA).
Kwas fenylopirogronowy[2] to związek chemiczny należący do grupy α-ketokwasów karboksylowych. Ulega także reakcji redukcyjnego aminowania do L-fenyloalaniny (L-Phe).
Mimo wielu doniesień literaturowych, mechanizm tej reakcji nie został do końca poznany.
Celem mojej pracy magisterskiej, było wyznaczenie parametrów kinetycznych (Vmax , KM ) oraz efektów rozpuszczalnikowych w badanych reakcjach z udziałem L-Phe oraz jej halogenopochodnych, co pozwoli zbadać wpływ podstawienia halogenowego na przebieg reakcji katalizowanych przez ten enzym.
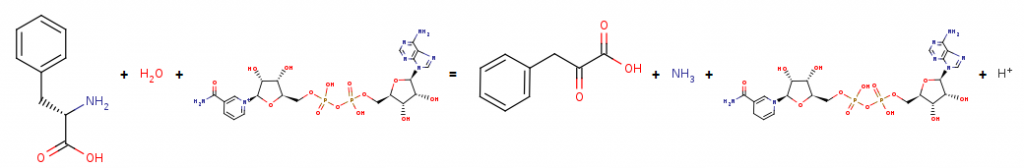
Rysunek [3]. Reakcja oksydacyjnej deaminacji L-fenyloalaniny do kwasu fenylopirogronowego.
Literatura:
[1] Enzymes, [w:] A.D. McNaught, A. Wilkinson, Compendium of Chemical Terminology (Gold Book), S.J. Chalk (akt.), International Union of Pure and Applied Chemistry, wyd. 2, Oxford: Blackwell Scientific Publications, 1997, DOI: 10.1351/goldbook.E02159, ISBN 0-9678550-9-8 (ang.).
[2] https://pubchem.ncbi.nlm.nih.gov/compound/Phenylpyruvic-acid.
[3] https://www.brenda-enzymes.org/enzyme.php?ecno=1.4.1.20#GENERAL%20INFORMATION.

